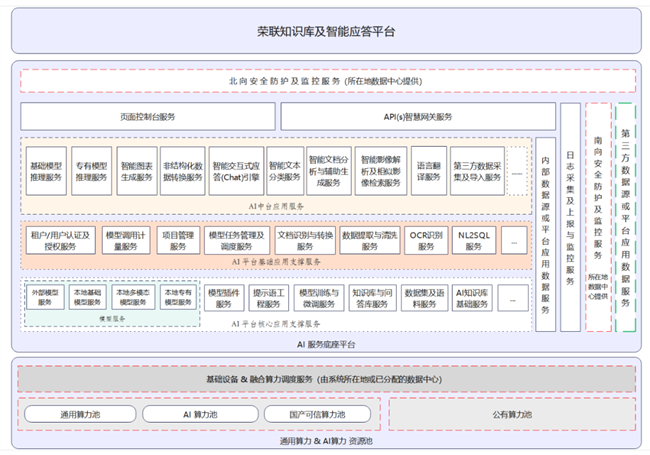
第二条产品管线获FDA批准I/II期临床,百吉生物持续推进全球首创CGT布局
2023年4月15日,百吉生物从美国FDA获悉,公司第二条全球首创产品管线EBV阳性淋巴瘤适应症I/II期临床试验申请已获得批准。上周,该适应症IND亦在国内获得NMPA批准。
此前,百吉生物首条管线用于治疗复发/转移性鼻咽癌的IND先后在中美两地获批。本次在美国获批开展EBV阳性淋巴瘤适应症临床试验I/II期,这意味着百吉生物中美双报上的又一里程碑。由此,百吉生物成为全球首家CGT行业中同时拥有两条产品管线均获得中美双报的创新药企业。
百吉生物向新加坡卫生科学局(HSA)的相关申报也正在进行中,今年陆续还有多款针对肺癌、肝癌、多种消化道类肿瘤等癌种的全球首创药品申报中美新三地I/II期临床试验许可。
百吉生物董事兼首席运营官陈秩静博士表示:“目前中美新三地都已将细胞治疗列为了国家重点发展战略,细胞治疗将成为各国经济增长的持续动力,还将给未攻克的疾病带去新的希望,造福更多患者。”

关于EBV阳性淋巴瘤:
EBV感染全球近95%人口,已被世界卫生组织定义为I类致癌物,与其相关的肿瘤主要包括鼻咽癌、胃癌、肺癌、淋巴瘤和淋巴细胞增生性疾病等。由于EBV具有明确的嗜淋巴细胞特性,对于免疫系统受损,特别是T细胞功能受损的人群,EBV被确认可以直接诱发淋巴细胞癌变。部分骨髓移植或者经过抗CD7 CAR-T治疗后的患者,体内EBV出现重新激活甚至发展为EBV阳性淋巴瘤。
百吉生物研制的新药是一款针对EBV阳性鼻咽癌和淋巴瘤的基因修饰的自体T细胞制品,属于过继性免疫细胞治疗技术。通过采集患者血液中的免疫细胞,在体外进行基因工程化改造,增强T细胞对肿瘤细胞的特异性识别与杀伤效力。回输进患者体内的自体T细胞可以通过多种免疫机制直接杀伤肿瘤细胞和提高机体针对肿瘤的免疫反应。本品的安全性和有效性已在前期探索性临床中得到初步验证。
百吉生物肩负致力于提供癌症患者最优的治疗方式的使命,针对多种未被攻克的实体肿瘤和血液肿瘤领域,凭借强大的科学智囊团和多年的积淀,自主创建了IDENTIFIER, SUPER-T, MSE-T等多项围绕肿瘤免疫治疗的独家技术平台,从抗原鉴定,抗体TCR筛选鉴定优化、免疫细胞功能模块筛选等方面着手攻破实体肿瘤免疫治疗的难点痛点。
关于百吉生物

百吉生物是一家专注细胞与基因治疗具有国际竞争力的创新药公司,主要致力于免疫细胞治疗领域的研究和创新,力争为肿瘤患者提供最佳的治疗方案。
百吉生物汇聚新加坡、中国、德国、澳洲、法国、美国三地六国顶尖科研人才,博士研发团队中毕业于全球排名前50大学的比例达80%,拥有国内外双研发双GMP生产基地,立足亚洲,面向全球,目前已布局产品市场规模超500亿美金。
百吉生物在治疗鼻咽癌、多种消化道类肿瘤、肝癌、肺癌、EBV阳性血液系统疾病等多种实体瘤和血液瘤领域拥有全球首创/同类最佳产品,其全球独家首创的BRG01 注射液新药临床试验(IND)正式获得国家药品监督管理局药品审评中心的临床试验默示许可和美国食品药品监督管理局(FDA)Ⅰ/Ⅱ期临床试验许可。百吉生物也是行业内为数不多产品管线同时覆盖 CART、TCRT、TIL、多特异性抗体等多种前沿免疫细胞治疗领域的生物科技公司。
百吉生物在新加坡、中国广州分别设有总部,与新加坡科技研究局(A*STAR)、慕尼黑赫姆霍兹中心(Helmholtz Zentrum München)、德国汉诺威医学院、中山大学附属肿瘤防治中心、郑州医科大学第一附属医院(排名不分先后)以及十多家三甲医院建立了紧密的研究合作关系,多管线产品在新加坡、澳大利亚、中国等国家开展临床试验。
百吉生物在新加坡和广州拥有成熟的技术研发和转化平台,技术创新和积累能力覆盖成药性研究、临床前研究、临床研究和生产转化等药品开发全周期,在国内外分别拥有双GMP生产与新药研发基地,实现了集研发、生产、销售于一体的全产业链布局。